Bestimmung der Gewässergüte
mit Hilfe des
chemischen Indexes
nach Bach
Auszüge aus:
Nau, Jochen: Quantitative chemische
Gewässeranalyse der Mosel,
"Jugend-forscht"-Arbeit, Gymnasium Konz
1998/99
Inhaltsverzeichnis
-
Allgemeine Bedeutung der Messwerte für
das Gewässer und
die Folgen geänderter Werte
-
Der pH-Wert
-
Die elektrische Leitfähigkeit
-
Die Sauerstoffkonzentration
-
Der biochemische Sauerstoffbedarf
(BSB)
-
Die Gewässertemperatur
-
Die Ammoniumkonzentration
-
Die Nitratkonzentration
-
Die Phosphatkonzentration
-
Versuchsdurchführung zur Erhebung
der Messparameter nach Bach
2.1. Sauerstoffmessung
(elektrometrisch)
bzw. Sauerstoffzehrung (BSB5-Wert)
2.2. Messung
des pH-Wertes (elektrometrisch)
2.3. Messung
der elektrischen Leitfähigkeit
2.4. Messung
der Gewässertemperatur (elektrometrisch)
2.5. Messung
der Ammoniumkonzentration (photometrisch)
2.6. Messung
der Phosphatkonzentration (photometrisch)
2.7. Messung
der Nitratkonzentration (photometrisch)
3. Berechnung
der Gewässergüteindices
-
Erläuterungen zu der Funktionsweise
der Messgeräte bzw. der Messfühler
4.1. Messprinzip
der
Sauerstoffmessung
4.2. Messprinzip
der pH-Wert-Messung
4.3.
Messprinzip der Leitfähigkeitsmessung
4.4. Messprinzip
der elektronischen Temperaturmessung
4.5. Messprinzip
der Photometrie
4.6. Nachweisreaktion
der Ammonium-Ionen
4.7. Nachweisreaktion
von Phosphat-Ionen
4.8. Nachweisreaktion
von Nitrat-Ionen
-
Anhang
Anhang 1: Tabellen der Indexwerte
zu den Messparametern nach Bach
Anhang 2: Protokollblatt zur chemischen
Gewässeruntersuchung nach Bach
Anhang 3: Löslichkeit von Sauerstoff
in Wasser als Funktion der Temperatur
Anhang 4: Löslichkeit von Sauerstoff
in Wasser als Funktion der Temperatur und des Luftdrucks
Anhang 5: Aufbau einer Sauerstoffelektrode
Anhang 6: Aufbau der Glasmembran einer
pH-Elektrode
Anhang 7: Die Lage des Ammonium-/ Ammoniakgleichgewichts
in Abhängigkeit von der Temperatur
Anhang 8: Aufbau eines Photometers
6. Literaturverzeichnis
-
Allgemeine Bedeutung der Messwerte
für das Gewässer und
die Folgen geänderter Werte
1.1. Der pH-Wert
Bedeutung:
Der pH-Wert gibt den Säuregrad eines
Gewässers an. Innerhalb einer Skala von 1 - 14 kennzeichnet pH 7 den
Neutralpunkt. Wasser enthält positiv geladene H3O+(aq)-Ionen
und negativ geladene OH --Ionen.1 Der pH-Wert ist
als negativer dekadischer Logarithmus der c (H3O+)
definiert, analog dazu der pOH-Wert als negativer dekadischer Logarithmus
der c (OH-).
Der pH-Wert des Gewässers wird allgemein
von den darin enthaltenen Säuren und Laugen [ z.B. das
Verhältnis der Stoffmengen an gelöstem Kohlendioxid (CO2)
und an Hydrogencarbonat (HCO3-)]
, sowie von den darin gelösten Salzen bestimmt.2
Chemische Folgen:
Der pH-Wert ist einerseits von der pflanzlichen
Produktion, andererseits von den eingeleiteten Abwässern abhängig.
Am Tag nehmen Pflanzen CO2 aus
dem Wasser auf. CO2 bildet mit Wasser eine schwache Säure.
Entsprechend steigt der pH-Wert. Analog dazu fällt er in der Nacht.
Einträge von vor allem stickoxid- oder schwefeldioxidhaltigen Verbindungen
können zu einem gefährlich niedrigen pH-Wert führen.1
Man muss verstärkt darauf achten,
dass industrielle Abwässer hinreichend neutralisiert sind, denn sie
können, neben der Schädigungen durch die eingeleiteten Stoffe
selbst auch durch eine pH-Wertänderung das ökologische Gleichgewicht
stören.5 So kann, aufgrund eines pH- abhängigen Gleichgewichts,
die Erhöhung des pH-Wertes eine starke Bildung von Ammoniak aus Ammonium-Ionen
herbeiführen. Bei pH 7 liegen zu 99 % Ammonium-Ionen vor, aber bei
pH 10 schon 80 % giftiges Ammoniak und nur noch zu 20 % ungiftiges Ammonium.1
Das Ammonium-Ion gelangt als Abbauprodukt eiweißhaltiger Abwässer
in die Flüsse.
Biologische Folgen:
Ammoniak ist ein starkes Fischgift. Der
pH-Wert beeinflußt sowohl bei Pflanzen als auch bei Tieren den Stoffwechsel.
Sinkt der pH-Wert unter 5,5 oder steigt er über 9, so ist kaum noch
höheres Leben möglich.
1.2. Die elektrische
Leitfähigkeit
Bedeutung:
Die elektrische Leitfähigkeit des
Wassers beruht allgemein auf seinem Gehalt an Ionen. Sie hängt im
wesentlichen ab von der Konzentration und dem Dissoziationsgrad der gelösten
Elektrolyte, sowie der Beweglichkeit der einzelnen Ionen.2
Die Leitfähigkeit ist ein sogenannter
Summenparameter, d. h. sie erlaubt eine pauschale Beurteilung des Ionengehaltes
des Wassers, lässt jedoch keine Aussagen über die jeweilige Ionenart
zu.2
Der elektrische Widerstand ist definiert
als die Spannung (U) durch die Stromstärke ( I ). Der Kehrwert des
Widerstandes ist der Leitwert (G). Bei konstanter Spannung ist der Leitwert
also nur abhängig von der Stromstärke, respektive vom Elektronentransport.
In Flüssigkeiten (Leiter 2. Ordnung) kann dieser Transport nicht direkt
erfolgen, sondern es werden Ionen als Transportmittel benötigt. Je
größer die Konzentration der Ionen und deren Beweglichkeit ist,
desto besser kann dieser Transport stattfinden. Folglich ist auch der Strom
größer, der fließt, also ist auch die elektrische Leitfähigkeit
höher.
Die geringste Leitfähigkeit hat chemisch
reines Wasser (destilliertes Wasser). Schon kleinste Verunreinigungen lassen
diese direkt stark ansteigen. Sie ist demnach ein wichtiges Beurteilungskriterium
für die Reinheit eines Wassertyps.2
Chemische Folgen:
Die Aufnahme von Gasen aus der Luft und
deren Reaktion zu Ionen ist der Grund für die höhere Leitfähigkeit
von Regenwasser. Es können hier Werte von etwa 60...100
m
S/cm auftreten, wobei sich oft ein deutlicher Zusammenhang mit dem pH-Wert
zeigt.2
Die hohe Leitfähigkeit fließender
Oberflächengewässer zeigt deren hohe Salzbelastung, die in erster
Linie von industriellen Abwässern, ausgewaschenen Düngemitteln
und von Streusalz herrührt.
Biologische Folgen:
Der hohe Nährsalzgehalt (Phosphate,
Nitrate) unserer Gewässer führt zu einem starken Algenwachstum.
Die absterbende große Masse an Algen wird durch Destruenten aerob
abgebaut. Ist der Sauerstoff eines Gewässers verbraucht, kommt es
zum anaeroben Abbau der Biomasse. Es entstehen Faulgase (z.B. Methan, Schwefelwasserstoff,
Ammoniak- bzw. Ammonium-Ionen). Durch den geringen Sauerstoffgehalt kommt
es zu einem Fischsterben.
1.3. Die Sauerstoffkonzentration
Sauerstoff ist für die meisten tierischen
und pflanzlichen Organismen im Wasser lebensnotwendig. Dieses Gas liegt
im Wasser gelöst vor und kann nur in dieser Form von Fischen, Kleintieren
und Bakterien verwertet werden.2 In das Wasser gelangt der Sauerstoff
auf zwei Wegen:
-
Durch den relativ höheren Partialdruck
des Sauerstoffs in der Atmosphäre diffundieren Sauerstoffmoleküle
in das Wasser. Dieser Prozess wird durch kaltes Wasser und durch eine hohe
Fließgeschwindigkeit und daraus bedingte Turbulenzen begünstigt.
-
Außerdem gelangt Sauerstoff durch photosynthesetreibende
Pflanzen (z.B. Algen, Wasserpflanzen oder Phytoplankton) in das Gewässer.
Dieser Form des Sauerstoffeintrages muss man in langsamen Fließgewässern
große Bedeutung beimessen. Sie ist außerdem lichtgebunden.
Deshalb unterliegt die Sauerstoffkonzentration großen Schwankungen
im Tagesrhythmus, was bei der Probennahme und Beurteilung berücksichtigt
werden muss. Die kritische Zeit ist hier der frühe Morgen, da die
Pflanzen während der Nacht keinen Sauerstoff produziert, sondern verbraucht
haben.
Ist das Wasser mit Sauerstoff gesättigt,
stehen die Partialdrücke des Sauerstoffs in der Luft und im Wasser
im Gleichgewicht. Dieser Wert ist von der Wassertemperatur abhängig
und nimmt mit steigender Temperatur stark ab (Anhang
3). Am Gewässer kann man eine Sauerstoffsättigung
an aufsteigenden Gasbläschen erkennen. Außerdem ist die Löslichkeit
von Sauerstoff im Wasser noch vom Luftdruck und vom Salzgehalt des Wassers
abhängig (Anhang 4).
Eine niedrige Sauerstoffkonzentration im
Gewässer ist im Wesentlichen auf aerobe Bakterien zurückzuführen,
die organische Stoffe abbauen. Diese sind teils natürlicher, teils
menschlicher Herkunft. Darunter sind abgestorbene Pflanzen und Tiere, Ausscheidungen
von Tieren, Einleitungen und Einschwemmungen aus Industrie, Verkehr und
Landwirtschaft, häusliche Abfälle, Fäkalien, belastende
Niederschläge, usw.1
Aufgrund des Abbaus durch aerobe Bakterien
ist auch ein Unterschied in der Sauerstoffkonzentration, zwischen Litoral
und Profundal bzw: Epilimnion und Hypolimnion vorhanden. Da die Biomasse
im Wasser nach unten sinkt, wird sie hauptsächlich im Hypolimnion
bzw. Litoral zersetzt, was zu einem erheblichen Sauerstoffverbrauch in
diesen Schichten führt. Dagegen ist die Sauerstoffkonzentration im
Epilimnion höher, da hier die photosynthesetreibenden Pflanzen Sauerstoff
produzieren.
Chemische Folgen:
Fehlt in einem Gewässer der Sauerstoff,
wird das organische Pflanzenmaterial anaerob, d.h. ohne Sauerstoff abgebaut,
wobei Faulgase entstehen (darunter giftiger Schwefelwasserstoff). Außerdem
kann das im Gewässerboden an Eisen gebundene Phosphat in sauerstofffreiem
Wasser wieder frei werden und als Dünger fungieren (das wasserunlösliche
Eisen-(III)-Phosphat wird zum löslichen
Eisen-(II)-Phosphat reduziert).
Biologische Folgen:
Der Mangel an Sauerstoff führt bei
Fischen zu verminderter Nahrungsaufnahme, sie erkranken leichter und werden
leichter von Parasiten befallen. Sauerstoffmangel muss jedoch nicht in
jedem Fall direkt zu einem Fischsterben führen, sondern er kann auch
einen schleichenden Tod nach sich ziehen.1 Außerdem sind
praktisch alle tierischen Organismen auf Sauerstoff angewiesen.
Da die Sauerstoffkonzentration wichtig
für das Überleben vieler Organismen ist, ist sie einer der stärker
gewichteten Faktoren im chemischen Index (CI).
1.4. Der biochemische
Sauerstoffbedarf (BSB)
Der biochemische Sauerstoffbedarf ist
ein Summenparameter für die Menge von organischen Substanzen im Wasser,
die von Bakterien abgebaut werden können. Für den Abbau dieser
Substanzen benötigen die Bakterien Sauerstoff. Ist ein Gewässer
stark mit organischen Substanzen verschmutzt, wird eine große Menge
Sauerstoff verbraucht. Ist sie vorhanden, hat das Wasser eine hohe Selbstreinigungskraft.
Ist diese Menge an Sauerstoff aber nicht vorhanden, werden die Substanzen,
unter der Entstehung von giftigem Schwefelwasserstoff, Methan, usw., anaerob
abgebaut. Der BSB5-Wert gibt also Aufschluss über die Gewässergüte
bzw. die Verschmutzung des Wassers.
Der BSB5-Wert ist die Menge
an Sauerstoff, die von einer Probe, bei völliger Abdunkelung und bei
20°
C, innerhalb von fünf Tagen verbraucht wird.
1.5. Die Gewässertemperatur
Bedeutung:
Die exakte Ermittlung der Gewässertemperatur
und der umgebenden Luft ist eine grundlegende Voraussetzung, da einige
der zu bestimmenden Parameter (Dazu gehören die Sauerstoffkonzentration
(Anhang 3 und
Anhang
4), der pH-Wert und die elektrische Leitfähigkeit.)
nämlich mehr oder weniger temperaturabhängig sind.
Insbesondere wird die Geschwindigkeit chemischer
Reaktionen stark von der Temperatur beeinflusst. Nach der RGT-Regel verdoppelt
bis verdreifacht sich die Reaktionsgeschwindigkeit bei einer Temperaturzunahme
um 10°
C. Dies gilt grundsätzlich auch für pflanzliche und tierische
Organismen, doch darf hier die Temperatur nicht zu hoch steigen (bis etwa
42°
C), da sonst Proteinstrukturen zerstört werden.
Die Temperatur von Gewässern ist stark
abhängig von der Sonneneinstrahlung. Außerdem werden häufig
warme Industrieabwässer oder Kühlwasser aus Kraftwerken in Fließgewässer
eingeleitet, die zu einer Temperaturzunahme führen. Nicht zuletzt
trägt der Mensch durch die Einleitung trüber Abwässer, die
Sonnenwärme absorbieren, zu einer Temperaturerhöhung bei.
Chemische Folgen:
Die Temperatur beeinflusst die Sauerstoffkonzentration
eines Gewässers. Bei höheren Temperaturen kann im Wasser deutlich
weniger Sauerstoff gelöst werden. Es nimmt jedoch gleichzeitig die
Geschwindigkeit sauerstoffverbrauchender Vorgänge zu (RGT-Regel).
Diese Tatsache kann insbesondere bei organisch stark verschmutzten Gewässern
zu einer rapiden Abnahme der Sauerstoffkonzentration führen.2
Biologische Folgen:
Eine zu starke Erwärmung hat Einfluss
auf die Zusammensetzung der Tier- und Pflanzenwelt eines Gewässers.3
Durch eine Veränderung des Lebensraumes (hier Zunahme der Wassertemperatur)
kommt es zu interspezifischer Konkurrenz. Eine ansässige Art, die
ihr Temperaturoptimmum bei einer niedrigeren Temperatur hat, kann unter
Umständen durch eine andere verdrängt werden, deren Temperaturoptimum
bei der höheren Temperatur liegt. Dies kann im Extremfall zu einem
starken Rückgang der Artenvielfalt führen.
Durch eine geringe Sauerstoffkonzentration
kann es zum Beispiel zu einem Fischsterben oder einem anaeroben Abbau der
Biomasse und einem dadurch bedingten Freiwerden von Methan und giftigen
Schwefelwasserstoffen kommen.
1.6. Die Ammoniumkonzentration
Bedeutung:
Ammonium (NH4+) bzw.
Ammoniak (NH3) werden beim Abbau stickstoffhaltiger organischer
Substanzen, vor allem Proteinen und Harnstoff, gebildet. Ammonium kann
auf drei Wegen in das Gewässer gelangen:
-
Als Exkremente menschlichen und tierischen
Ursprungs. Deshalb muss ein positiver Ammoniumbefund auch unter hygienischen
Gesichtspunkten als bedenklich angesehen werden. Deshalb sind begleitende
Untersuchungen auf Escherichia Coli-Bakterien sinnvoll.
-
Durch Düngerausschwemmungen kann Ammonium
unter Umständen direkt in ein Gewässer gelangen, was meist mit
einer erhöhten Sulfat- oder Chloridkonzentration einhergeht.
-
Ammonium-Ionen entstehen auch bei verschieden
Vorgängen im Wasserkörper und im Sediment. Darunter sind:
-
Sowohl im aeroben, als auch im anaeroben Milieu
die Ammonifikation, bei der PON (partikuläre organische Stickstoffverbindungen)
und DON (gelöste organische Stickstoffverbindungen) durch Pilze und
fakultativ anaerobe Bakterien (Pseudomonas, Bacillus, Proteus) zu Ammonium
umgewandelt werden.
-
Im anaeroben Milieu die Nitratammonifikation,
bei der Nitrat durch Bakterien (Bacillus, Escherichia, Enterobacter) zu
Ammonium reduziert wird.
Die Werte für die Ammoniumkonzentration
können stark schwanken, meist liegen sie jedoch zwischen 0,1 und 3
mg/l. Unbelastete Oberflächengewässer sollten ganzjährig
weniger als 0,1 mg/l NH4+ enthalten. In verunreinigten
Gewässern lassen sich Konzentrationen bis zu 10 mg/l feststellen.2
Chemische Folgen:
In wässrigen Lösungen findet
man ein vom pH-Wert abhängiges Gleichgewicht zwischen Ammonium-Ionen
und freiem Ammoniak (Anhang 7).
Das fischgiftige Ammoniak ist nur in alkalischem Wasser beständig.
In saurem Wasser bildet sich das ungefährliche Ammonium-Ion.2
Neben der Abhängigkeit vom pH-Wert ist das Gleichgewicht zwischen
Ammoniak und Ammonium auch von der Temperatur abhängig. Zur Beurteilung
der Fischgiftigkeit einer bestimmten Ammoniumkonzentration ist neben der
pH-Messung auch eine Temperaturmessung notwendig.
Biologische Folgen:
In Oberflächengewässern kann
der Eintrag von Ammonium, hauptsächlich aus Kläranlagenabläufen,
infolge der einsetzenden Nitrifikation [
erst eine Nitritation (NH4+ ®
NO2-) durch Nitrosomonas, Nitrosospira, Nitrosovibri
und dann eine Nitratation (NO2- ®
NO3-) durch Nitrobacter, Nitrospina, Nitrococcus]
- soweit es nicht unmittelbar von den Mikroorganismen und Wasserpflanzen
in den Stoffwechsel einbezogen wird - zu einer erheblichen Belastung des
Sauerstoffhaushalts, wenn nicht gar zu dessen Zusammenbruch führen.
Für die mikrobakterielle Oxidation zu Nitrat werden für 1 mg
NH4-Stickstoff etwa 4,6 mg Sauerstoff verbraucht.2
1.7. Die Nitratkonzentration
Bedeutung:
Das Vorhandensein von Nitrat ist meist
auf die Mineralisation von organischen Stickstoffverbindungen, beispielsweise
auf den vollständigen Abbau der aus Proteinen entstehenden Aminosäuren,
zurückzuführen.5 In zwei Stufen wird vorhandenes oder
eingeleitetes Ammonium zunächst bakteriell zu Nitrit (Nitritation)
und dann zu Nitrat (Nitratation) oxidiert.
Nitrat ist ein wichtiger Baustein für
die Protein-Biosynthese, der von allen Lebewesen benötigt wird. In
hoher Konzentration fördert Nitrat jedoch das übermäßige
Wachstum von Algen und trägt zur Eutrophierung bei.1 Wenn
eine erhöhte Nitratkonzentration aber nicht mit einer erhöhten
Ammonium- und Nitritkonzentration einhergeht, kann daraus gefolgert werden,
dass die Selbstreinigungskraft des Gewässers zur Mineralisation organischer
Stickstoffverbindungen ausreichend war.
Wenn eine hohe Nitratkonzentration nicht
auf Ausschwemmungen aus natürlichen Salpeterlagern zurückzuführen
ist, liegt immer eine Verschmutzung des Gewässers vor. Nitrat und
Ammonium gelangen in diesem Fall durch Exkremente von Tieren, abgestorbene
Pflanzenteile und Tierleichen, durch Fäkaleinleitungen, Gülle
und Düngemittel, oder durch unzureichende Kläranlagen in das
Gewässer.1
Nitrat ist in fast allen Gewässern
in geringer Menge nachweisbar. In natürlichen unbelasteten Oberflächengewässern
sind Nitrat-Ionen meist in Konzentrationen von
0,4 - 8 mg/l vorhanden. In verunreinigten,
belasteten Gewässern können Nitratkonzentrationen von 50
- 150 mg/l und mehr auftreten.2
Chemische Folgen:
Die eutrophierende Wirkung des Nitrats
kann zu einer Sauerstoffarmut führen. Bei Sauerstoffmangel besteht
die Gefahr das sich größere Mengen des giftigen Nitrits bilden.
Biologische Folgen:
Das Nitrit verändert den Blutfarbstoff
Hämoglobin; Nitritvergiftete Tiere gehen an Atemnot zugrunde. Dieser
Effekt kann auch bei zu hohen Nitratkonzentrationen auftreten, da sich
Nitrat im Darmsystem teilweise zu Nitrit umbildet. Durch Reaktionen mit
Aminen bilden sich krebserregende Nitrosamine. Auch wir Menschen können
auf Dauer von höheren Nitratkonzentrationen geschädigt werden.1
1.8. Die Phosphatkonzentration
Bedeutung:
Phosphat kommt in den Gewässern in
drei Fraktionen vor: Als anorganisch gelöstes Phosphat (Ortho-Phosphat
oder Polyphosphat P2O5), als organisch gelöstes
Phosphat und als organisch partikuläres Phosphat; die beiden letzten
Fraktionen sind in Lebewesen gebunden.1 Das Phosphat ist in
unbelasteten Gewässern nur in geringsten Spuren vorhanden, da es relativ
schnell von Pflanzen bzw. Algen gebunden wird oder als wasserunlösliches
Eisen-(III)-Phosphat im Boden festgelegt
wird. Damit verliert das Phosphat zunächst seine eutrophierende Wirkung.
Der natürliche Phosphateintrag spielt
heute kaum noch eine Rolle. Die heutigen hohen Phosphatbelastungen sind
häufig auf Verschmutzungen zurückzuführen. Dies erkennt
man daran, dass die Phosphatkonzentrationen in zeitlicher Abhängigkeit
starken Schwankungen unterliegen. Die heutigen Verschmutzungen stammen
aus der Erosion von Ackerböden und der damit verbundenen Einschwemmung
von Düngemitteln, aus der Einleitung industrieller Abwässer und
nicht zuletzt aus Siedlungsabwässern [
vor allen Dingen Waschmittel und Fäkalien (etwa 4,5 g Phosphat je
Tag und Mensch)]
. Selbst nach mechanischer und biologischer Reinigung in Kläranlagen
gelangen noch große Phosphatmengen in das Gewässer, da das Phophat
in der biologischen Stufe nur zu Ortho-Phosphat abgebaut wird.1
Deshalb sind ab 5000 EWG (Einwohnergleichwerte) chemische Stufen in den
Kläranlagen vorgeschrieben.
Natürliche unbelastete Gewässer,
insbesondere Gebirgsgewässer, haben Phosphatkonzentrationen unter
0,1mg/l, meist sogar weniger als 0,03 mg/l. Bei Phosphatwerten über
0,3 mg/l besteht immer ein starker Verdacht auf Verunreinigung des Gewässers.2
Chemische Folgen:
In sauerstoffreichen Wasser wird Phosphat
im Sediment als wasserunlösliches Eisen (III)
Phosphat gebunden. Kommt es jedoch zu einer Sauerstoffarmut (z.B. nach
einer Algenblüte) am Boden des Gewässers, wird das Eisen-(III)-Phosphat
zum wasserlöslichen Eisen-(II)-Phosphat
reduziert. Die großen Mengen des freigewordenen Phosphats heizen
noch einmal die Eutrophierung an.
Biologische Folgen:
Das Phosphat ist meistens der Minimumfaktor
beim Pflanzen- und Algenwachstum. Kommt es jedoch zu ständigen Phosphateinleitungen
steigert sich auch zunächst die Menge des Photo- und Zooplanktons,
was letztendlich zu einem starken Anstieg abgestorbener Biomasse führt.
Diese Biomasse wird von aeroben Bakterien unter Sauerstoffverbrauch zersetzt.
Die Zersetzungsprozesse belasten schließlich immer mehr den Sauerstoffhaushalt,
bis die abgestorbene Biomasse nur noch anaerob abgebaut werden kann und
als Faulschlamm den Boden bedeckt. In dieser Situation tritt auch der in
" chemische Folgen " beschriebene Vorgang auf.
Zurück zum Inhaltsverzeichnis.
-
Versuchsdurchführung zur Erhebung
der Messparameter nach Bach
2.1.Sauerstoffmessung
(elektrometrisch) bzw. Sauerstoffzehrung (BSB5-Wert)
Die Messung der Sauerstoffkonzentration
des Wassers erfolgt elektrometrisch mit Hilfe eines Oximeters (Leybold
Hand-O2-Meter) und einer Sauerstoffelektrode
(Leybold).
Versuchsbeschreibung:3
-
Kalibrieren des Oximeters
-
Durchführung der Sauerstoffmessung aus
der gerade entnommenen Probe (Wert A in Prozent)
-
Notieren des Wertes zur Aufnahme in den Gewässergüteindex
und zur Berechnung der Sauerstoffzehrung
-
Drei Flaschen luftblasenfrei mit Probenwasser
füllen
-
Die Flaschen werden mit Alufolie abgedunkelt
-
Bebrütung der Flaschen bei 20° C
-
Nach 48 Stunden wird die Sauerstoffkonzentration
in den Flaschen gemessen. Dieser Wert (Wert B in Prozent) dient zur Berechnung
des BSB5-Wertes.
Versuchsauswertung:
Die Sauerstoffkonzentration des Wassers
wird in mg / l oder in Prozent angegeben. Für die Berechnung des Gewässergüteindexes
benötigt man die Angabe in Prozent, da die Indexwerte den Prozentzahlen
zugeordnet sind.
Berechnung des BSB2 - bzw. BSB5
- Wertes:
Wert A - Wert B = BSB2
BSB2 x 1,85 = BSB5
Außerdem fließt Wert
A auch in den Gewässergüteindex
ein.
Zurück zur Bedeutung der Sauerstoffkonzentration.
2.2. Messung
des pH-Wertes (elektrometrisch)
Die Messung des pH-Wertes erfolgt elektrometrisch
mit Hilfe eines pH-Meters (Leybold Hand-pH-Meter [666221]),
eines Temperaturfühlers (Leybold Temperaturfühler Pt 1000 [666241])
und einer Einstabmesskette
(Leybold pH-Einstabmesskette [666417]).
Versuchsbeschreibung:3
-
Kalibrieren des pH-Meters (mit Temperaturfühler
und Einstabmesskette)
-
Mit einem Becherglas etwa 50-100 ml Wasserprobe
entnehmen (Becherglas vorher gut mit der Probe ausspülen)
-
Beide Fühler in das zu untersuchende
Wasser tauchen, Probenlösung oder Elektrode leicht bewegen und nach
ca. 30 s den Messwert ablesen
-
pH-Wert notieren
-
pH-Elektrode und Temperaturfühler gut
mit destiliertem Wasser abspülen
-
Messwerte notieren
Versuchsauswertung:
Die notierten
pH-Werte in der Einheit pH fließen
in den Gewässergüteindex
ein.
Zurück zur Bedeutung des pH-Wertes.
2.3. Messung
der elektrischen Leitfähigkeit
Die Messung der elektrischen Leitfähigkeit
von Gewässern erfolgt elektrometrisch mit Hilfe eines Leitfähigkeitsmessgeräts
(Konduktometer) (Leybold Hand-Leitfähigkeitsmessgerät [
666222]
) und einer Leitfähigkeitsmesszelle mit integriertem Temperaturfühler
(Leybold Leitfähigkeitsmesszelle mit integrierter Temperatursonde
[
666242]
.
Versuchsbeschreibung:3
-
Kalibrierung des Messgeräts
-
Messzelle in Wasserprobe eintauchen und mit
gleichmäßiger Bewegung kreisend rühren
-
Messwert notieren
-
Messzelle aus der Flüssigkeit nehmen
und mit destilliertem Wasser abspülen
Versuchsauswertung:
Die gemessenen
Werte werden in [
m
S/cm ] umgerechnet
und deren Indexwerte
werden im Gewässergüteindex verrechnet.
Zurück zur Bedeutung der elektrischen Leitfähigkeit.
2.4. Messung
der Gewässertemperatur (elektrometrisch)
Zur Messung der Temperatur verwendete
ich ein elektronisches Digital-Thermometer mit dem Temperaturmessfühler
Pt 1000 der Firma Leybold (666241). Ein Digital-Thermometer ist im pH-Meter
(Leybold Hand-pH-Meter [
666241]
) integriert.
Versuchsdurchführung:3
-
In den Messmodus Temperatur gehen
-
Temperaturfühler in die Wasserprobe oder
direkt in das Gewässer halten und die Temperatur nach 20 Sekunden
ablesen
-
Den Messwert notieren
-
Den Messfühler reinigen
Versuchsauswertung:
Die Temperaturangaben haben die Einheit
°
C. Die notierten Messwerte fließen
in den Gewässergüteindex ein.
Zurück zur Bedeutung der Gewässertemperatur.
2.5. Messung
der Ammoniumkonzentration (photometrisch)
Versuchsbeschreibung (Spektroquant 14752):
-
Einstellen des Photometers (WTW MPM 2010):
Messbereich 0,07-1,93 mg/l, Filterposition 5, Einheit mg/l, Anzeigeform
NH4-N
-
5 ml Ansatz (T = 20 - 30 ° C)
-
Zugabe von 0,6 ml NH4-1B (alkalische Lösung
mit Komplexierungsmitteln) mit Spritze; mischen
-
Zugabe von einem Mikrolöffel blau NH4-2B
(Dichlorisocyanursäure)
-
5 min stehen lassen
-
Zugabe von 4 Tropfen NH4-3B (Natriumsalicylat
und Natriumnitroprussid als Katalysator)
-
5 min stehen lassen
-
Messung bei 690 nm gegen Blindprobe (Mischung
der Reagenzien mit destilliertem Wasser. Die Färbung und damit die
Extinktion der Blindprobe [
gelbliche Färbung]
wird von der der Probe abgezogen, um die tatsächliche Extinktion,
und damit die Konzentration, des Ammoniums festzustellen)
-
Notieren der Messergebnisse
Versuchsauswertung:
Die Messergebnisse werden in mg/l angegeben
und fließen in den Gewässergüteindex
ein.
Zurück zur Bedeutung der Ammoniumionenkonzentration
2.6. Messung
der Phosphatkonzentration (photometrisch)
Versuchsbeschreibung (Spectroquant
14842):
-
Einstellen des Photometers (WTW MPM 2010):
Messbereich 0,5-25 mg/l, Filterposition 1, Einheit mg/l, Anzeigeform PO43--P
-
5 ml Ansatz
-
Zugabe von einer Spritze (1,2 ml) P-AH (Reduktionsmittel,
Katalysator, Ammoniumheptamolybdat in halbkonzentrierter Schwefelsäure);
mischen
-
Messung bei 690 nm gegen Blindprobe
-
Notieren der Messergebnisse
Versuchsauswertung:
Die Messergebnisse werden in mg/l angegeben
und fließen in den Gewässergüteindex
ein.
Zurück zur Bedeutung der Phosphationenkonzentration.
2.7.Messung
der Nitratkonzentration (photometrisch)
Versuchsbeschreibung (Spectroquant
14773):
-
Einstellen des Photometers (WTW MPM 2010):
Messbereich 1,0-20,0 mg/l, Filterposition 6, Einheit mg/l, Anzeigeform
NO3--N
-
Zugabe von einem Mikrolöffel blau NO3-1A
(Zinkzubereitung, Sulfanilsäure, 1-Naphthylamin)
-
Zugabe von 5 ml NO3-2A mit Spritze; NO3-1A
(Schwefelsäure) darin lösen
-
Zugabe von 1,5 ml Probelösung und sofortiges
Mischen (Vorsicht, Wärmeentwicklung!)
-
10 min stehen lassen
-
Messung bei 515 nm
-
Notieren der Messergebnisse
Versuchsauswertung:
Die Messergebnisse werden in mg/l angegeben
und fließen in den Gewässergüteindex
ein.CIBerechnung
Zurück zur Bedeutung der Nitrationenkonzentration.
3. Berechnung
der Gewässergüteindices
Zur Auswahl stehen, zum einen der chemische
Gewässergüteindex (CI) nach Bach und der nach G.R.E.E.N.
Ich habe mich aus mehreren Gründen für den ersteren entschieden.
Dieser Index ist rein chemischer Natur, d.h. dass nur relativ leicht zu
messende Faktoren erhoben werden. Ein weiterer Vorteil vom CI nach Bach
ist, dass sich durch die Potenz in der Berechnung des Index einzelne schlechte
Parameter stärker auf den CI auswirken, was zumindest für bestimmende
Parameter (z.B. pH-Wert) den biologischen Auswirkungen entspricht (Fische
können z.B. bei einem ph-Wert von unter 4,5 nicht überleben).
Der international anerkannte Index nach Bach basiert auf umfangreichen
Vorarbeiten, die in mehreren Ländern, von verschiedenen Wissenschaftlern,
durchgeführt wurden. (Erfassungsbogen
nach Bach: siehe Anhang 2).
Bach verwendet einen sogenannten multiplikativen
Index. Dabei werden die Indexzahlen (jeder Messwert hat eine bestimmte
Indexzahl, die aus der Tabelle im Anhang zu entnehmen sind) mit den dazugehörigen
Wichtungen potenziert. Die so entstandenen Zahlen werden anschließend
multipliziert.
Der multiplikative Index hat zur Folge,
dass sich Extremwerte stärker auf die Gesamtberechnung auswirken.
Dies kommt der Situation im Gewässer sicher nah, da auch dort Extremwerte
den Ausschlag für die Qualität geben können.1
Allgemein sieht die Berechnungsformel für
die Methode von Bach folgendermaßen aus:
CI = I1W1 •
I2W2 •
I3W3 •
I4W4 •
I5W5 •
I6W6 •
I7W7 •
I8W8
wobei I1…I8 die Indexzahlen
(Anhang 1)
und W1...W8 die entsprechenden Wichtungen sind (Anhang
2).
Vergleichsskala:
Chemischer Index (CI) - Gewässergüteklassifikation (GKL)
|
CI
|
100...83
|
82...74
|
73...56
|
55...45
|
|
GKL
|
I
unbelastet bis gering belastet
|
I-II
gering belastet
|
II
mäßig belastet
|
II-III
kritisch belastet
|
| |
44...27
|
26...16
|
17... 1
|
|
| |
III
stark verschmutzt
|
III-IV
sehr stark
verschmutzt
|
IV
übermäßig verschmutzt
|
|
Zurück zum Inhaltsverzeichnis.
4. Erläuterungen zu der Funktionsweise
der Messgeräte bzw. der Messfühler
4.1.Messprinzip
der Sauerstoffmessung
Im Reaktionsraum befinden sich eine Gold-
(Arbeitselektrode), und eine Silberelektrode (Bezugselektrode), wobei die
Au-Elektrode die Kathode (Minuspol und die Ag-Elektrode die Anode (Pluspol)
bilden. Der Reaktionsraum wird durch eine semipermeable Membran, die für
gelösten Sauerstoff durchlässig, für gelöste Ionen
aber undurchlässig ist, vor dem Außenmedium geschützt.
Der gelöste Sauerstoff kann aufgrund eines Diffusionsgefälles,
von außen nach innen, durch die Membran diffundieren. An der Goldelektrode
wird der Sauerstoff reduziert. Die dadurch bedingte Spannungsänderung
ist direkt proportional zu der vorhandenen Menge an Sauerstoff. Die Elektronik
berechnet hieraus die aktuelle Sauerstoffkonzentration (Anhang 5).
Als Anode bezeichnet man allgemein die
Elektrode, an der eine Oxidation stattfindet, als Kathode die Elektrode,
an der eine Reduktion stattfindet.
4.2. Messprinzip
der pH-Wert-Messung
Hierbei wird die Potentialdifferenz (Spannung)
zwischen zwei, in das zu untersuchende Wasser eingetauchte Elektroden,
der Bezugselektrode und der Messelektrode (Indikatorelektrode) bestimmt.
Oft werden auch beide Elektroden zu einer einzigen Elektrode, der Einstabmesskette,
kombiniert. Als Messelektrode dient dabei eine Glaselektrode, an der ein
pH - abhängiges Potential auftritt. In diese Glaselektrode ist eine
Bezugselektrode eingebaut (meist eine Silber / Silberchlorid-Elektrode),
die ein konstantes, vom pH-Wert der Messlösung unabhängiges Potential
liefert. Die zwischen Mess- und Bezugselektrode auftretende Potentialdifferenz
wird dann in einem Messverstärker mit sehr hohem Innenwiderstand,
dem pH-Meter, verstärkt und zur Anzeige gebracht.3
Funktion einer Einstabmesskette
Eine Glaselektrode hat an ihrem unteren
Ende eine kugelförmige Glasmembran, die aus einem dreidimensionalen
Gerüst aus Si- und O-Atomen besteht, in das Kationen, wie zum Beispiel
Li+ eingelagert sind.3 Beim Eintauchen der Glaselektrode
in eine wässrige Lösung bildet sich an der Aussenseite der Glaselektrode,
wie bereits an der Innenseite eine Quellschicht, indem Li+-Ionen,
die nach Aussen diffundieren, durch H+-Ionen bzw. H3O+-Ionen
ersetzt werden. Unterscheidet sich nun die Konzentration der H3O+-Ionen
in der Quellschicht und Puffer- bzw. Messlösung so diffundieren H3O+-Ionen
zu der Membran und bilden sowohl an der Phasengrenze Membran / Pufferlösung,
als auch an der Phasengrenze Membran / Messlösung ein elektrisches
Potential, wobei das erstere konstant bleibt und das zweite von der c (H3O+)
abhängig ist (Anhang 6).
Mit einem pH-Schritt ändert sich das
Potential um etwa 57-59 mV (bei 25°
C). Diesen Wert bezeichnet man als Steilheit der Elektrode.
Das auftretende Potential ist außerdem
temperaturabhängig. Für jede ganze pH-Einheit beträgt die
Abweichung 0,033 pH/10°
C. 3
4.3. Messprinzip
der Leitfähigkeitsmessung
Das Konduktometer liefert Wechselspannung
einer hohen Frequenz ( 1000 Hz ) an die Messzelle, die im wesentlichen
aus zwei Platinelektroden besteht. Die zwischen den Elektroden auftretende
Stromstärke wird gemessen und in die Leitfähigkeit umgerechnet.3
Die Verwendung von Gleichstrom könnte
die Messwerte verfälschen, da eine Polarisation der Elektroden, infolge
der Abscheidung von Ionen, auftreten kann. Diese Polarisation kann aber
hinreichend klein gehalten werden, wenn mit hochfrequentem Wechselstrom
und einer großen effektiven Elektrodenoberfläche gearbeitet
wird.
Der spezifische Widerstand (r
) eines Leiters ist: r
= R• q/l
[
W
×
cm]
Der Kehrwert des Widerstands ist die Leitfähigkeit
(k ):k
= l/r =
l/R• l/q
[
W
-1
×
cm-1]
Der Quotient l/q (l = Elektrodenabstand
und q = Elektrodenoberfläche) einer Leitfähigkeitsmesszelle wird
als Zellkonstante C bezeichnet. Die Abmessungen einer Messzelle werden
meistens so gewählt, dass C exakt 1,00 cm-1 ist (l = 1,00
cm; q = 1,00 cm2). Damit erübrigt sich eine Eichung.3
Da man W
-1
auch als S (Siemens) bezeichnet ergibt sich als Maßeinheit für
die elektrische Leitfähigkeit [
S/cm ] .
4.4. Messprinzip
der elektronischen Temperaturmessung
Der Temperaturmessfühler besteht
aus einem Platindraht dessen elektrischer Widerstand temperaturabhängig
ist und bei 0°
C genau 100 W
beträgt. Der Widerstand des Fühlers wird vom Messgerät in
die entsprechende Temperatur umgerechnet.5
Bei steigender Temperatur nimmt der Widerstand
metallischer Leiter zu, da die Atomrümpfe stärker zu schwingen
beginnen und deshalb den Elektronenfluss behindern. In niedrigen Temperaturbereichen
kann ein linearer Zusammenhang zwischen der Temperatur und dem Widerstand
angenommen werden, was die Eichung des Thermometers sehr vereinfacht.
4.5. Messprinzip
der Photometrie
Zur Photometrie benutzt man hauptsächlich
monochromatisches Licht im sichtbaren Bereich (etwa 400 nm-700nm), da Licht
dieser Wellenlängen beim Durchgang durch Materie (hier: farbige Verbindung
aus Reagenzien und dem gesuchten Stoff) absorbiert wird. Die Absorption
ist dadurch begründet, dass Elektronen in p
-Bindungen (bei Molekülen) und d- bzw. f-Orbitalen (bei Atomen bzw.
Ionen) angeregt werden.
Die Grundlage für die Photometrie
ist das Lambert-Beer¢
sche Gesetz, das die Proportionalität zwischen der Konzentration einer
Lösung und der Extinktion (Absorption) angibt (Anhang 17, Abb 2).
Es lautet:
E = e
•
d• c oder
E = -lg l / l0
e ist der molare
dekadische Extinktionskoeffizient, d die Schichtdicke der Lösung (Küvettendicke),
c die Konzentration des durch die Reaktion mit den zu untersuchenden Ionen
entstandenen Farbstoffs und l / l0 bezeichnet man als
Transmission.
Die chemischen Grundlagen der Photometrie
beruhen darauf, dass der zu untersuchende Inhaltsstoff mit den zugegebenen
Reagenzien eine farbige Verbindung bildet, wobei die Intensität der
Färbung der Konzentration des Inhaltsstoffes entspricht. Die Bildung
des Farbstoffes muss reproduzierbar sein, d.h. unter gleichen Reaktionsbedingungen
muss immer die gleiche Menge Farbstoff entstehen.3 Es muss außerdem
verhindert werden, dass die Reagenzien mit anderen, nicht zu bestimmenden
Inhaltsstoffen auch den Farbstoff bilden. Dies geschieht durch Maskierungsmittel
(" Komplexbildungsmittel "), die genauso in den Reagenziensätzen vorhanden
sind, wie Pufferlösungen zum Einstellen eines konstanten pH-Wertes.
Da sich viele Farbstoffe unter der Einwirkung von Licht und Sauerstoff
zersetzen, muss die Messung nach der in der Versuchsbeschreibung angegebenen
Zeit erfolgen.
Aufbau eines Photometers
Von einer monochromatischen Lichtquelle
aus wird ein Strahlenbündel durch eine Küvette geschickt, in
der sich die Probe befindet. Hinter der Küvette trifft das nicht absorbierte
Licht auf eine Photodiode. Der auftretende Kurzschlussstrom ist ein Maß
für die auftreffende Lichtintensität, also auch für die
Konzentration des in der Probe enthaltenen Stoffes (Anhang 8).
4.6. Nachweisreaktion
der Ammonium-Ionen
Die Bestimmung von Ammoniak und Ammonium-Ionen erfolgt photometrisch
nach der Bildung eines blauen Indophenol-Farbstoffes gemäß den
deutschen Einheitsverfahren (DEV).
Der Anzeigebereich des Tests liegt bei 0,01-3,5 mg/l
Die Nachweisreaktion läuft in stark alkalischem Medium bei pH 13
ab. Bei diesem pH-Wert liegt der Ammonium-Stickstoff vollständig als
NH3 vor. Ammoniak reagiert zunächst vollständig mit
Hypochlorid-Ionen (ClO-), die bei der Hydrolyse von Dichlorisocyanursäure
gebildet werden (a), zu Monochloramin (NH2Cl) (b). Dieses reagiert
dann unter der Wirkung eines Katalysators mit Natriumsalicylat zu einem
blauen Indophenolfarbstoff (Berthelot-Reaktion). Die folgenden Reaktionsschritte
werden angenommen:2

4.7. Nachweisreaktion
von Phosphat-Ionen
Der Nachweis von Phosphat-Ionen erfolgt photometrisch nach Bildung
von Phosphormolybdänblau. Das beschriebene Verfahren ermöglicht
die Bestimmung von PO43--Konzentrationen im Bereich
von 0,2 - 15 mg/l.
Die Nachweisreaktionen laufen in stark schwefelsaurer Lösung bei
pH< 1 ab. Bei
diesem pH-Wert bildet sich aus Ammoniumheptamolybdat zunächst Isopolymolybdänsäure
(a), die mit Phosphaten zu Phosphormolybdänsäure reagiert (b),
wobei die vier O-Atome des Phosphats durch vier (Mo3O10)-Gruppen
ersetzt werden. Anschließend erfolgt die Reduktion zu Phosphormolybdänblau
(c).
Dabei handelt es sich um ein Mischoxid
in den Oxidationsstufen +IV bis +VI.2

4.8. Nachweisreaktion
von Nitrat-Ionen
Die Bestimmung von Nitrat-Ionen im Wasser erfolgt photometrisch nach
Reduktion zu Nitrit und Bildung eines rot-violetten Azofarbstoffes. Das
Verfahren ermöglicht die Bestimmung von NO3---Konzentrationen
im Bereich von 1-140 mg/l
Die Nachweisreaktion läuft in schwefelsaurer Lösung ab. Zunächst
werden die Nitrat-Ionen zu Nitrit-Ionen reduziert (a). Diese wiederum reagieren
in saurer Lösung mit primären aromatischen Aminen, z.B. Sulfanilsäure,
unter Bildung von Diazoniumsalzen (b). Das gebildete Diazoniumsalz kuppelt
schließlich mit 1-Naphthylamin, einer aromatischen Verbindung mit
Aminogruppe, zu einem rotviolett gefärbten Azofarbstoff (c).2

Zurück zum Inhaltsverzeichnis.
5.Anhang
Anhang 1:Tabellen der Indexwerte zu den
Messparametern
nach Bach
| BSB5
[ mg/l] |
|
Sauerstoffgehalt
[%] |
|
| O2 - Zehrung |
Index |
O2 - Gehalt |
Index |
| 0,0 |
100 |
0 |
2 |
| 0,5 |
99,5 |
5 |
2 |
| 1,0 |
98 |
10 |
3 |
| 1,5 |
95 |
15 |
4,5 |
| 2,0 |
90 |
20 |
6 |
| 2,5 |
84 |
25 |
9 |
| 3,0 |
76 |
30 |
12 |
| 3,5 |
68 |
35 |
15 |
| 4,0 |
61 |
40 |
19 |
| 4,5 |
54 |
45 |
24 |
| 5,0 |
48 |
50 |
30 |
| 5,5 |
42 |
55 |
36 |
| 6,0 |
37 |
60 |
43 |
| 7,0 |
28 |
65 |
53 |
| 8,0 |
20,5 |
70 |
63 |
| 9,0 |
14,5 |
75 |
71 |
| 10,0 |
10 |
80 |
79 |
| 15,0 |
4 |
85 |
86 |
| 15,0 |
3 |
90 |
93 |
| |
|
95 |
99 |
| |
|
96 |
100 |
| |
|
106 |
100 |
| |
|
110 |
97 |
| |
|
115 |
95 |
| |
|
120 |
90,5 |
| |
|
125 |
87 |
| |
|
130 |
83 |
| Temperatur
[oC] |
|
Phosphatkonzentrat. |
|
| T |
Index |
PO43- (aq) |
Index |
| <14 |
100 |
0,0 |
100 |
| 14 |
100 |
0,1 |
95 |
| 15 |
99 |
0,2 |
84 |
| 16 |
97,5 |
0,3 |
72 |
| 17 |
95 |
0,4 |
60 |
| 18 |
90 |
0,5 |
48 |
| 19 |
79 |
0,6 |
39 |
| 20 |
67,5 |
0,7 |
31,5 |
| 21 |
56 |
0,8 |
25 |
| 22 |
45 |
0,9 |
20 |
| 23 |
33,5 |
1,0 |
16 |
| 24 |
22 |
1,1 |
12,5 |
| 25 |
15 |
1,2 |
10 |
| 26 |
9 |
1,3 |
8 |
| 27 |
5,5 |
1,4 |
7 |
| 28 |
3 |
1,5 |
6 |
| 29 |
1,5 |
1,6 |
5,5 |
| 30 |
1,0 |
1,8 |
5 |
| 30 |
1,0 |
2,0 |
5 |
| |
|
2,5 |
4 |
| |
|
3,0 |
3 |
| |
|
4,0 |
2 |
| |
|
5,0 |
1 |
| Ammoniumkonzentr.
[mg/l] |
|
Nitratkonzentration
[mg/l] |
|
| NH4+ (aq) |
Index |
NO3- (aq) |
Index |
| 0,0 |
100 |
0 |
100 |
| 0,2 |
84 |
2 |
94 |
| 0,4 |
60 |
4 |
88 |
| 0,6 |
49 |
6 |
82 |
| 0,8 |
40 |
8 |
76 |
| 1,0 |
35 |
10 |
70,5 |
| 1,2 |
31 |
12 |
64,5 |
| 1,4 |
28,5 |
14 |
58,5 |
| 1,6 |
26,5 |
16 |
52,5 |
| 1,8 |
24,5 |
18 |
46,5 |
| 2,0 |
23 |
20 |
40,5 |
| 2,5 |
20 |
22 |
35,5 |
| 3,0 |
18 |
24 |
30 |
| 4,0 |
15,5 |
26 |
26 |
| 5,0 |
12 |
28 |
23 |
| 6,0 |
10 |
30 |
20 |
| 8,0 |
6,5 |
36 |
15 |
| 10,0 |
4,5 |
40 |
10 |
| 13,0 |
3,5 |
40 |
10 |
| 13,0 |
3 |
|
|
| pH - Wert |
|
Leitfähigkeit
[mS/cm] |
|
| PH |
Index |
LF |
Index |
| 3,0 |
1 |
0,000 |
72 |
| 3,5 |
2,5 |
0,025 |
85 |
| 4,0 |
7 |
0,050 |
91 |
| 4,5 |
13 |
0,075 |
95 |
| 5,0 |
22 |
0,1 |
97,5 |
| 5,5 |
34,5 |
0,125 |
99,5 |
| 6,0 |
56,5 |
0,15 |
100 |
| 6,5 |
78,5 |
0,175 |
99,5 |
| 6,6 |
83 |
0,2 |
98,5 |
| 6,7 |
87,5 |
0,225 |
97 |
| 6,8 |
92 |
0,250 |
95,5 |
| 6,9 |
96 |
0,275 |
93 |
| 7,0 |
98,5 |
0,3 |
91 |
| 7,1 |
99,5 |
0,35 |
85 |
| 7,2 |
100 |
0,4 |
77 |
| 7,3 |
100 |
0,45 |
70 |
| 7,4 |
99,5 |
0,5 |
63 |
| 7,5 |
98,5 |
0,55 |
56 |
| 7,6 |
96 |
0,6 |
50 |
| 7,7 |
92 |
0,7 |
39 |
| 7,8 |
87,5 |
0,8 |
31 |
| 7,9 |
83,5 |
0,9 |
24 |
| 8,0 |
78,5 |
1,0 |
19 |
| 8,5 |
55,5 |
1,1 |
15 |
| 9,0 |
33 |
1,2 |
13 |
| 9,5 |
18 |
1,3 |
11 |
| 10,0 |
10,5 |
1,4 |
10 |
| |
|
1,5 |
9 |
| |
|
2,0 |
8 |
| |
|
3,0 |
6 |
| |
|
4,0 |
4 |
| |
|
5,0 |
2 |
Werte übernommen aus: Amt für Schule Hamburg: Gewässer
im Stadtteil. Das Umweltprojekt G.R.E.E.N., Hamburg 1994, S. 90
Anhang 2:Protokollblatt zur chemischen
Gewässeruntersuchung nach Bach1
Gewässer: ____________ Messstelle: _________________
Fluss-Km: ________
Datum: __________ Uhrzeit: ________ Untersucher: ______________________
Witterung:
Lufttemperatur:____ Niederschläge am Untersuchungstag: (1)
viel (2) wenig (3) keine
Niederschläge in den letzten Tagen: (1) viel (2) wenig (3)
keine
Wasserkörper:
Breite: _____ m Tiefe: _____ m Fließgeschwindigkeit:
_______ m/sec
Farbe: _______________ Geruch: ___________________
| Beschattung: |
(1) fehlend |
(2) teilweise |
(3) völlig |
| Pflanzen: |
(1) Unterwasserpflanzen |
(2) Schwimmblattpflanz. |
(3) Röhricht |
| Sonstiges: |
(1) Ölfilm |
(2) Schaumbildung |
(3) Müll |
| |
(4) |
|
|
Ufer:
| Neigung:(1)senkr. |
(2) steil |
(3) mäßig steil |
(4) flach |
(5) sumpfig |
| Bewuchs: |
(1) kein Bewuchs |
(2) Gras |
(3) Sträucher |
(4) Baumbestand |
| Ausbau: |
(1) naturnah |
(2) Steinschüttung |
(3) Mauer |
(4) verrohrt |
| Einleiter: |
(1) Seitenbach |
(2) Graben |
(3) Rohr |
|
Landschaft:
| Flussverlauf: |
(1) kurvenreich |
(2)leicht gewunden |
(3) gerade |
(4)künstl. begradigt |
| Umgebung: |
(1)Wiesen/Weiden |
(2) Felder |
(3) Brachland |
(4) Wald |
| |
(5) Park |
(6) Ortschaft |
(7) Industrie |
(8)anders: ______ |
Messergebnisse:
Allgem. Berechnungsformel: CI
= I1W1 •
I2W2 •
I3W3 •
I4W4 •
I5W5 •
I6W6 •
I7W7 •
I8W8
è
CI
______________=
___0,08 •
___0,2 •
___0,2 •
___0,1 •
___0,1 •
___0,1 •
___0,15 •
___0,07 = _____
-> GKL = _______
Anhang 3:Löslichkeit von Sauerstoff
in Wasser als Funktion der Temperatur3
|
Temperatur [oC]
|
Löslichkeit von Sauerstoff in Wasser bei einem Luftdruck
von 1013,25 hPa [mg/l]
|
|
0
|
14,62
|
|
1
|
14,22
|
|
2
|
13,83
|
|
3
|
13,46
|
|
4
|
13,11
|
|
5
|
12,77
|
|
6
|
12,45
|
|
7
|
12,14
|
|
8
|
11,84
|
|
9
|
11,56
|
|
10
|
11,29
|
|
11
|
11,03
|
|
12
|
10, 78
|
|
13
|
10,54
|
|
14
|
10,31
|
|
15
|
10,08
|
|
16
|
9,87
|
|
17
|
9,66
|
|
18
|
9,47
|
|
19
|
9,28
|
|
20
|
9,09
|
|
21
|
8,91
|
|
22
|
8,74
|
|
23
|
8,58
|
|
24
|
8,42
|
|
25
|
8,26
|
|
26
|
8,11
|
|
27
|
7,97
|
|
28
|
7,83
|
|
29
|
7,69
|
|
30
|
7,56
|
Anhang 4:Löslichkeit von Sauerstoff
in Wasser als Funktion der Temperatur und des Luftdrucks3
|
Temperatur [oC]
|
Luftdruck [hPa]
111,5
|
Luftdruck [hPa]
1013
|
Luftdruck [hPa]
912
|
|
0
|
16,09
|
14,62
|
13,14
|
|
5
|
14,06
|
12,77
|
11,48
|
|
10
|
12,43
|
11,29
|
10,15
|
|
15
|
11,10
|
10,08
|
9,05
|
|
20
|
10,02
|
9,09
|
8,14
|
|
25
|
9,12
|
8,26
|
7,4
|
|
30
|
8,35
|
7,56
|
6,76
|
Anhang 5:Aufbau einer Sauerstoffelektrode
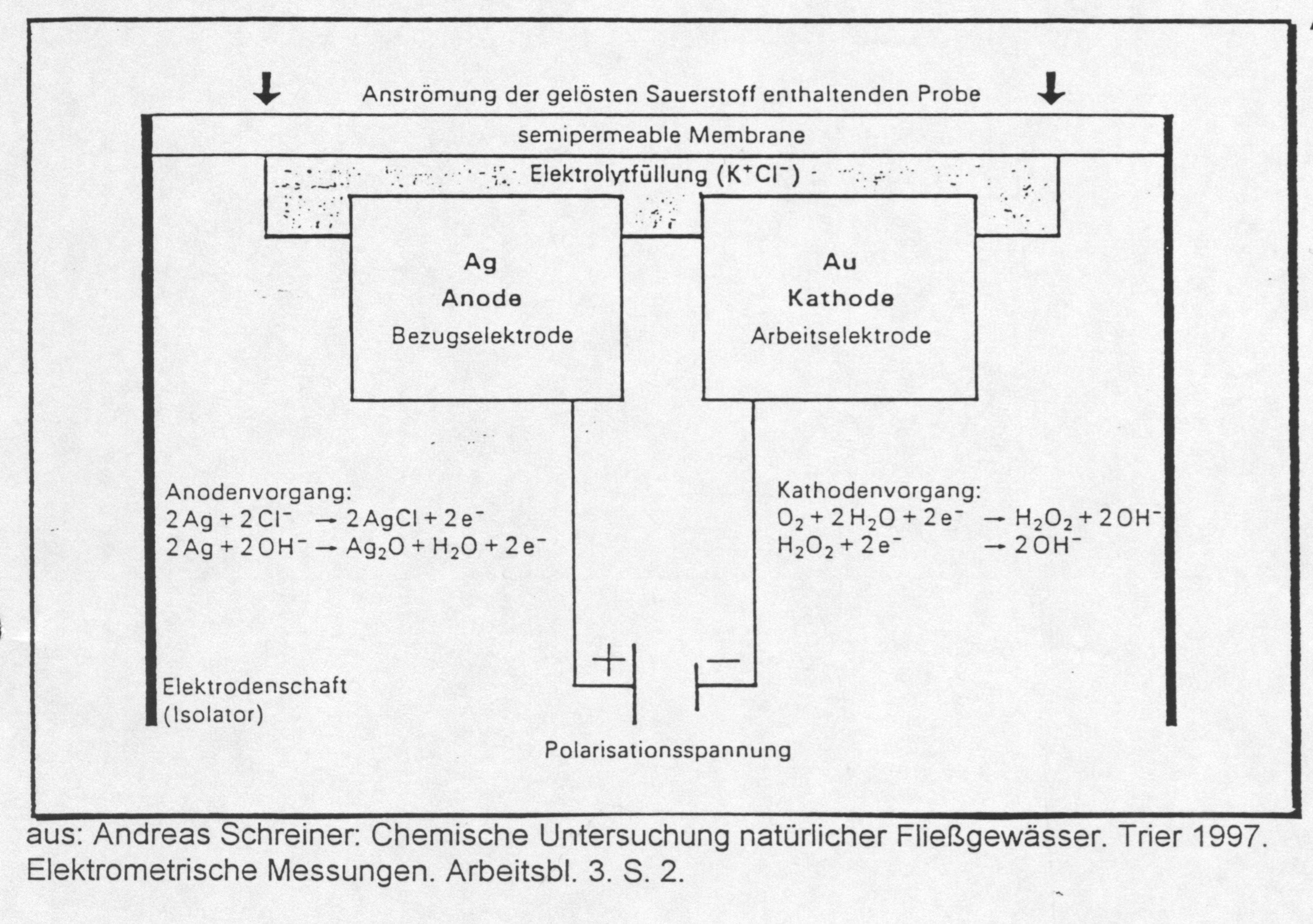
Anhang 6:Aufbau der Glasmembran einer pH-Elektrode

Anhang 7:Die Lage des Ammonium-/ Ammoniakgleichgewichts
in Abhängigkeit von der Temperatur

Anhang 8:Aufbau eines Photometers

| Strahlungsquelle
kontinuierl. oder diskontinuierl.
Licht |
Optik u. Blende
Sammellinse,
Parallelstrahlung |
Lichtzerlegung
Filter oder Monochromator, Wellenlänge des
Absorptionsmax.d. gebild.Farbstoffs wird eingestellt |
Blende, Küvette
mit Analysenlösung oder Vergleichslösung |
Photozelle,Anzeige
Umwandlung von Lichtenergie in elektrische Energie, die angezeigt wird |
Zurück zum Inhaltsverzeichnis.
Inhaltsverz
Literaturverzeichnis
1 Amt
für Schule Hamburg (Hg.): Gewässer im Stadtteil. Das Umweltprojekt
G.R.E.E.N. Hamburg. 1994.
4 Bach,
Erwin: Ein chemischer Index zur Überwachung der Wasserqualität
von Fließgewässern. DGM 24. 4/5 1980.
3 Engler,
Breuer, Müller und Seithe: Ökologie. Theoretische Grundlagen
und Versuche mit dem Umweltmesskoffer. Hürth. 1996.
2 Schreiner,
Andreas: Chemische Untersuchung natürlicher Fließgewässer.
Staatliches Studienseminar für das Lehramt an Gymnasien. Trier. 1997.
Zurück zum Inhaltsverzeichnis.
