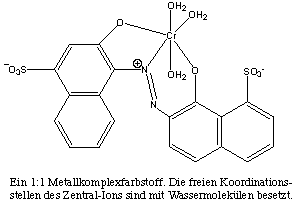
Die ersten, 1915 entwickelten Metallkomplexfarbstoffe waren 1:1-Komplexe, in denen ein Chrom-Ion ein Farbstoffmolekül bindet. Die Färbung mit diesen Farbstoffen erfordert ein stark saures Säurebad von pH=2 (z.B.: ® Palatin-Echtfarbstoffe). Eine die Faser schonende Färbung ist in schwach saurer Lösung mit 1:2-Metallkomplexen möglich, in denen pro Metall-Ion zwei Farbstoffmoleküle enthalten sind (z.B.: ® Ortolan-Farbstoffe).
|
|
|
|
|
|
|
Verwendung:
Mit Metallkomplexfarbstoffen können Proteinfasern wie Wolle und Seide, sowie synthetische Polyamidfasern angefärbt werden. Die Bindung zur Faser erfolgt durch VAN DER WAALS-Bindungen, elektrostatische Anziehungskräfte sowie durch Komplexbindung mit den Amino-Gruppen der Protein-Moleküle. Dadurch ergibt sich eine feste Haftung des Farbstoffs mit einer hohen Waschechtheit.
In letzter Zeit wurden Polypropylenfasern mit einem geringen Gehalt an Ni2+-Ionen hergestellt, die Azofarbstoffe unter Komplexbindung mit der Faser verankern. Auf diese Weise lassen sich mit der hydrophoben und daher schwierig anfärbbaren Polypropylenfaser gute Färbungen erzielen.
Weiterhin finden sie Anwendung in der Sofortbildphotographie (Polaroid).
Beispiele:
1.) Azofarbstoffe und Metallsalze:
In Verbindung mit Azofarbstoffen und Metallsalzen entstehen Azopigmente in Form von Lackdispersionen, die sich durch hohe Farbstärke auszeichnen. Daher werden sie auch in der Farbphotograhie verwendet, das Verfahren heißt Silberfarb-Bleichverfahren:
R-N==N-R' + AgCl2 Metallkomplex-Farbstoff-Lacksysteme
Azofarbstoff + Silbersalz Photo-Farbstoffe
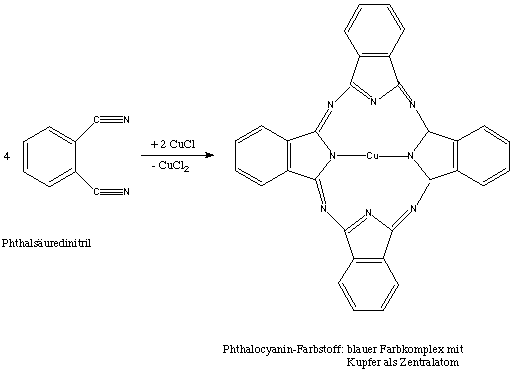
2.) Phthalocyanin-Farbstoffe: Metallhaltige organische Pigmente auf Basis des Phthalocyanins
Diese Farbstoffe werden als Pigmente, Küpenfarbstoffe oder Direktfarbstoffe verwendet. Verwendung finden sie auch als Stempelfarben für Lebensmitteloberflächen und -verpackungen, sowie zum Färben von Eierschalen. Die Phthalocyaninfarbstoffe werden auch in der präparativen organischen Chemie als Polymerisationsbeschleuniger bzw. als Katalysator genutzt.
Eigenschaften: Sie sind relativ temperaturunempfindlich, haben zum Teil Halbleiter-Eigenschaften und können mit bestimmten Radikalen lichtempfindliche Reaktionen zeigen. In ihrer Struktur zeigen sie eine gewisse Ähnlichkeit mit Chlorophyll oder Hämoglobin.
|
|
|
|
|
|
|
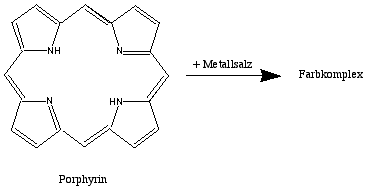
3.) Metall-Porphyrine:
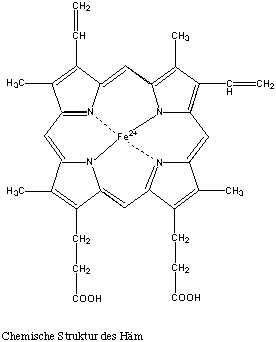
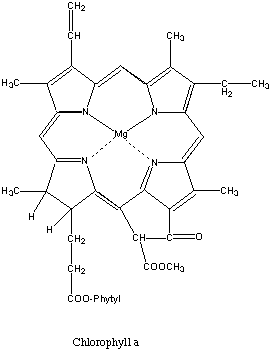
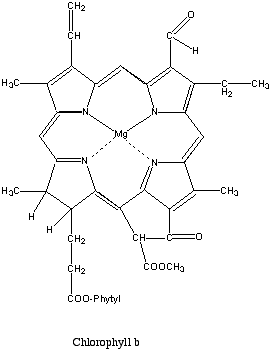
Das Chlorophyll in den Pflanzen und die Blut- und Muskelfarbstoffe Hämoglobin und Myoglobin sind Porphyrin-Metall-Derivate (Eisenproteine).
Chlorophyll Magnesiumion als Zentralatom
Häm des Hämoglobins Eisenion als Zentralatom
|
|
|
|
|
|
|
|||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
Versuch:
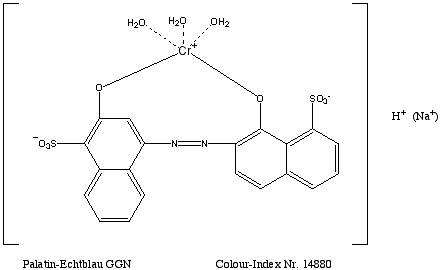
Färben mit Palatin-Echtblau GGN:
Versuchsdurchführung:
Man gibt zu 500ml Wasser von 50 Grad Celsius 0,3ml Uniperol 0 und 0,6g 96%ige Schwefelsäure, darin löst man 0,4g Farbstoff. In diesem Bad können nun 10g Wollgarn gefärbt werden, indem man die Temperatur langsam zum Kochen erhöht und 1,5 Stunden bei Kochtemperatur behandelt. Anschließend spült man.